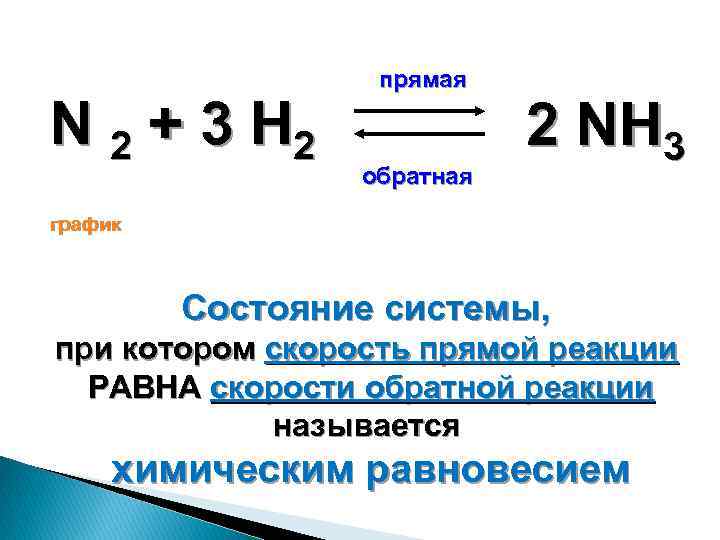
N2 3h2 2nh3 q экзотермическую реакцию. N2+h2 окислительно восстановительная реакция. N2+3h2 2nh3+q овр. Изменение равновесия в химических реакциях при давлении. N2+3h2 2nh3.
C2h2 cu nh3 2cl. Экзотермическая реакция синтеза аммиака n2 3h2 -> 2nh3. N2 + o2 ↔ 2no экзотермическая. Экзотермическая реакция равновесие. N2 3h2 2nh3 q экзотермическую реакцию.
[cu(nh3)2cl2]. N2+3h2 2nh3. N2 h2 nh3 окислительно восстановительная. N2 h2 nh3 катализатор. Определите тип окислительно-восстановительной реакции n2+h2 nh3.
N2 h2 nh2 окислительно восстановительная реакция. N2 3h2 2nh3 q экзотермическую реакцию. N2 3h2 2nh3 q экзотермическую реакцию. N2 3h2 2nh3 q экзотермическую реакцию. Сместить химическое равновесие вправо n2+o2 2no q.
N2+h2 уравнение. Как давление влияет на равновесие химической реакции. Классификация химической реакции n2+3h= 2nh. Уравнение реакции синтеза аммиака (nh3. Экзотермическая окислительно восстановительная реакция соединения.
N2 3h2 2nh3 q экзотермическую реакцию. Коэффициентами уравнения n2 h2 nh3 являются. Уравнение синтеза аммиака n2 3h2 2nh3. N2 h2 nh3 катализатор. N2 o2 no экзотермическая или эндотермическая.
N2 o2 2no эндотермическая или экзотермическая реакция. N2 3h2 2nh3 q экзотермическую реакцию. Химическая реакция n2->nh3. Уравняйте коэффициенты h2+n2🔛nh3. Сумма коэффициентов в реакции n2+h2 nh3 равна.
N2 h3 nh3. Реакция разложения аммиака. N2 3h2 2nh3 q экзотермическую реакцию. N2 3h2 2nh3 q экзотермическую реакцию. N2+3h2 2nh3 овр.
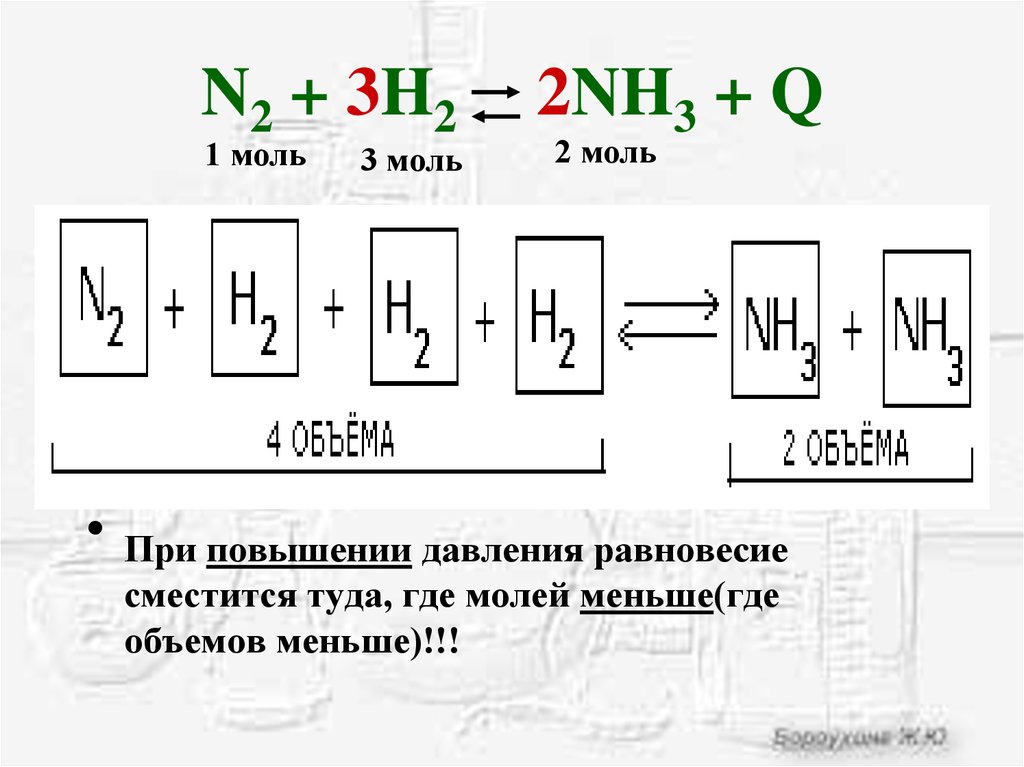
Смещение химического равновесия давление. N2 o2 2no смещение равновесия. N2 3h2 2nh3 q экзотермическую реакцию. N2 3h2 2nh3 q экзотермическую реакцию. N2+h2 уравнение реакции.
N2 h2 nh3 овр. N2 3h2 2nh3 q экзотермическую реакцию. N2 3h2 2nh3 q химическое равновесие. N2 3h2 2nh3 катализатор. Сместить равновесие вправо n2+o2=no-q.
Реакция соединения n2+h2. N2 h2 nh3. N2 3h2 2nh3 q экзотермическую реакцию. Синтез аммиака из простых веществ реакция. 2nh3 = n2 + 3h катализатор.
N2 h2 nh3. N2+3h2 nh3. N2 3h2 2nh3 q экзотермическую реакцию. N2+3h2 2nh3. N2 o2 при повышении давления.
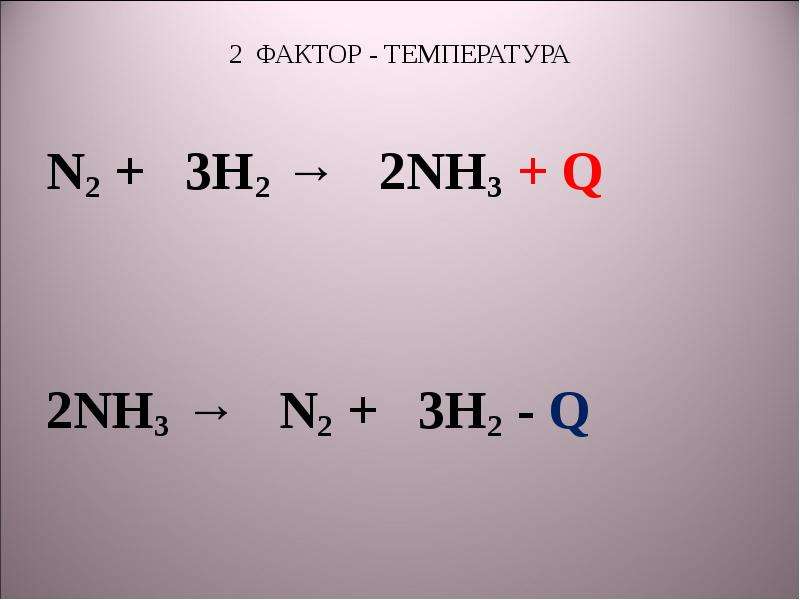
N2+3h2 2nh3+q. N2 г 3h2 г 2nh3 г. N2 3h2 2nh3 q экзотермическую реакцию. Разложение nh3 на простые вещества. N2+3h2 2nh3+q овр.
N2 3h2 2nh3 q экзотермическую реакцию. N2 3h2 2nh3 q экзотермическую реакцию. N2 h2 nh3 катализатор. N2+3h2 окислительно восстановительная. N2 3h2 2nh3 q экзотермическую реакцию.
Синтез аммиака из простых веществ. N2+3h2. No+o2 no2 экзотермическая или эндотермическая. Условия протекания реакции n2+h2=nh3. N2 3h2 2nh3 q экзотермическую реакцию.
N2 3h2 2nh3 тип реакции. N2+3h2 2nh3+q характеристика. N2 3h2 2nh3 q экзотермическую реакцию. N2+h2=nh2. Понижение температуры при эндотермической реакции.
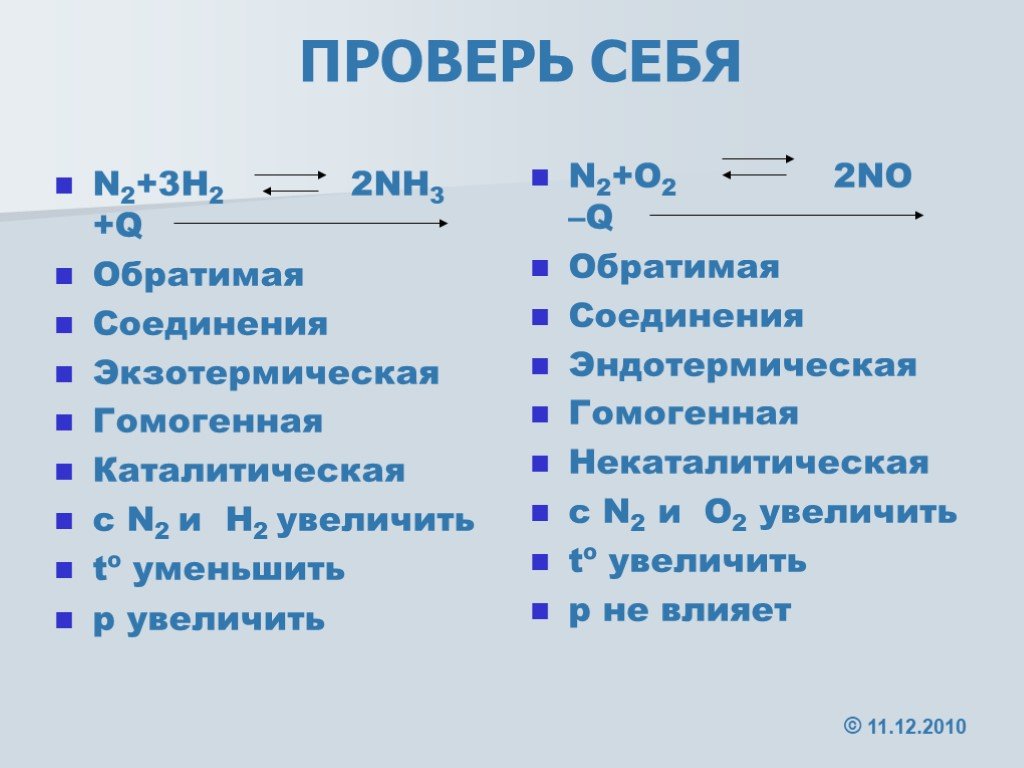
Скорость реакции и химическое равновесие. N2+3h2 2nh3. В какую сторону сместится равновесие реакции. Определите тип окислительно-восстановительной реакции n2+h2 nh3. N2 h3 nh3.
N2+h2. N2+h2 катализатор nh3+q. Экзотермическая реакция синтеза аммиака n2 3h2 -> 2nh3. N2 h2 nh2 окислительно восстановительная реакция. N2 h2 nh3 катализатор.
N2+3h2 2nh3. N2 h2 nh3 овр. N2 3h2 2nh3 q экзотермическую реакцию. Синтез аммиака из простых веществ реакция. Условия протекания реакции n2+h2=nh3.
Смещение химического равновесия давление. N2 h2 nh3. Определите тип окислительно-восстановительной реакции n2+h2 nh3. N2 h3 nh3. N2+3h2 nh3.


![[cu(nh3)2cl2]. N2+3h2 2nh3. N2 h2 nh3 окислительно восстановительная. N2 h2 nh3 катализатор. Определите тип окислительно-восстановительной реакции n2+h2 nh3. [cu(nh3)2cl2]. N2+3h2 2nh3. N2 h2 nh3 окислительно восстановительная. N2 h2 nh3 катализатор. Определите тип окислительно-восстановительной реакции n2+h2 nh3.](https://present5.com/presentation/345070093_451859403/image-30.jpg)











![[cu(nh3)2cl2]. N2+3h2 2nh3. N2 h2 nh3 окислительно восстановительная. N2 h2 nh3 катализатор. Определите тип окислительно-восстановительной реакции n2+h2 nh3. [cu(nh3)2cl2]. N2+3h2 2nh3. N2 h2 nh3 окислительно восстановительная. N2 h2 nh3 катализатор. Определите тип окислительно-восстановительной реакции n2+h2 nh3.](https://present5.com/presentation/345070093_451859403/image-30.jpg)















